Доктор медицинских наук Сучарит Бхакди, доктор философии Карина Рейсс и доктор медицинских наук Майкл Палмер считают данную технологию весьма тревожной.
1. Обоснование необходимости разработки вакцин
Концепция, лежащая в основе разработки вакцины, проста: применение безвредного производного инфекционного агента должно стимулировать иммунную систему к выработке антител, которые защищают от этого агента.
Однако введение любого чужеродного вещества в организм никогда не может быть полностью лишено рисков, поэтому главный вопрос, который необходимо решить, заключается в том, можно ли ожидать, что польза перевесит риски. Поэтому,
- возбудитель должен быть опасным — заражение им связано с высокой заболеваемостью и смертностью, и
- вакцинация обеспечит надежную иммунологическую защиту от тяжелых заболеваний.
Эти требования были выполнены в ходе исторических успехов в разработке вакцин против оспы, столбняка, дифтерии и полиомиелита. Однако эйфория, вызванная этими научными достижениями, привела к тому, что один решающий факт был упущен из виду. Во всех четырех случаях возбудители были доставлены к месту назначения в кровотоке.
Важно понимать, что это исключение, а не правило. Большинство вирусных патогенов вызывают самоограничивающиеся инфекции дыхательных путей или желудочно–кишечного тракта.
Серьезные повреждения внутренних органов, вызванные их распространением через кровоток, происходят нечасто, и инфекции, как правило, не связаны с высоким уровнем смертности. Из-за их повсеместного распространения высокий уровень фонового иммунитета к таким вирусам уже присутствует у населения в целом.
По этим простым причинам реальной необходимости в разработке вакцин против большинства вирусных патогенов не существует.
2. Иммунитет к респираторным вирусам: системный или слизистый иммунитет
Теперь мы обратимся к важному факту, касающемуся защиты дыхательных путей от инфекций: она осуществляется клетками иммунной системы, которые находятся внутри и под нашими слизистыми оболочками дыхательных путей, и эти клетки функционируют совершенно независимо от тех иммунных клеток, которые защищают наши внутренние органы.
Ключевой аспект этого функционального разделения между слизистым и системным иммунитетом касается природы антител, вырабатываемых плазматическими клетками, расположенными непосредственно под слизистыми оболочками.
Эти антитела — секреторный иммуноглобулин А (sIgA) — секретируются через слизистые оболочки к их поверхности. Таким образом, они находятся на месте встречи с вирусами, переносимыми воздушно-капельным путем, и могут быть способны предотвратить их связывание и заражение клеток внутри этих слизистых оболочек. Такой же способ защиты относится и к пищеварительному тракту.
Напротив, IgG и циркулирующий IgA являются основными антителами, обнаруживаемыми в кровотоке. Они не могут предотвратить проникновение вирусов в клетки, выстилающие дыхательные пути или кишечник, и в лучшем случае могут противодействовать их распространению, если они попадают в кровоток.
Важно отметить, что вакцины, которые вводятся в мышцу, то есть внутрь тела, будут индуцировать только IgG и циркулирующий IgA, но не секреторный IgA.
Следовательно, антитела, индуцируемые такими вакцинами, не могут и не будут эффективно защищать клетки дыхательных путей от заражения вирусами, передаваемыми воздушно–капельным путем [1,2]. Это осознание не является ни спорным, ни новым. Еще 30 лет назад Макги и др. [2] заключение:
Удивительно, что, несмотря на наш нынешний уровень понимания общей иммунной системы слизистой оболочки, почти все современные вакцины вводятся людям парентеральным путем [то есть путем инъекции].
Системная иммунизация по существу неэффективна для индукции иммунных реакций слизистой оболочки. Поскольку большинство инфекционных микроорганизмов встречаются через участки поверхности слизистой оболочки, логично рассмотреть индукцию защитных антител и Т-клеточных реакций в тканях слизистой оболочки.
Неспособность внутримышечной инъекции индуцировать секреторный IgA была подтверждена в исследовании ближневосточного респираторного синдрома (MERS) [3]. Как и COVID–19, это заболевание вызывается коронавирусом, и экспериментальная вакцина, использованная в исследовании, была основана на генах, как и все основные вакцины, применяемые в настоящее время против COVID-19.
Совсем недавно другое исследование показало, что мРНК COVID-вакцины также не стимулируют существенную выработку секреторного IgA [4]. По этой простой причине нельзя ожидать, что вакцинация будет препятствовать инфицированию дыхательных путей.
Действительно, полная неспособность вакцин предотвратить инфекцию SARS-CoV-2 сегодня полностью задокументирована [5,6].
Общеизвестно, что секреторные антитела IgA (sIgA) вырабатываются в ответ на естественные инфекции дыхательных путей. Следовательно, слизистые оболочки здоровых людей покрыты антителами, направленными против распространенных респираторных вирусов.
Однако способность этих антител предотвращать инфекции ограничена. Исход встречи с вирусом не является “черным или белым” — цифры имеют первостепенное значение. Стена защитных антител может отразить мелкомасштабную атаку, но она будет разрушена при более высоких вирусных нагрузках.
Вот почему инфекции, передаваемые воздушно–капельным путем, повторяются на протяжении всей жизни, и этот факт не будет изменен даже при использовании интраназальных вакцин для стимулирования выработки sIgA, хотя применение интраназальной вакцины вызывает более сильные иммунные реакции слизистой оболочки, чем внутримышечная инъекция [3,7].
Подчиненная роль секреторного IgA в борьбе с системными вирусными инфекциями подчеркивается тем фактом, что лица с очень распространенным генетическим дефектом — селективным дефицитом sIgA, — которые не способны вырабатывать sIgA, не страдают от резко повышенной восприимчивости к тяжелым респираторным инфекциям.
Это наблюдение можно понять из следующих двух принципов: во-первых, иммунологическая защита от респираторных вирусов основывается главным образом на Т-клетках; и, во-вторых, у лиц с уже существующим иммунитетом уровни антител в кровотоке (циркулирующие IgG и IgA), как правило, достаточны для предотвращения тяжелого заболевания в результате распространения вируса в организме.
3. Ключевые игроки в противовирусном иммунитете: Т-лимфоциты
Т-лимфоциты имеют решающее значение для борьбы с респираторными инфекциями, и это действительно распространяется на вирусные инфекции в целом.
Теперь внимание обращено на эти клетки, в результате чего обсуждение может быть первоначально сосредоточено на функции цитотоксических Т-лимфоцитов (CTL).
Что распознают эти клетки и каковы кардинальные последствия этого иммунного распознавания?
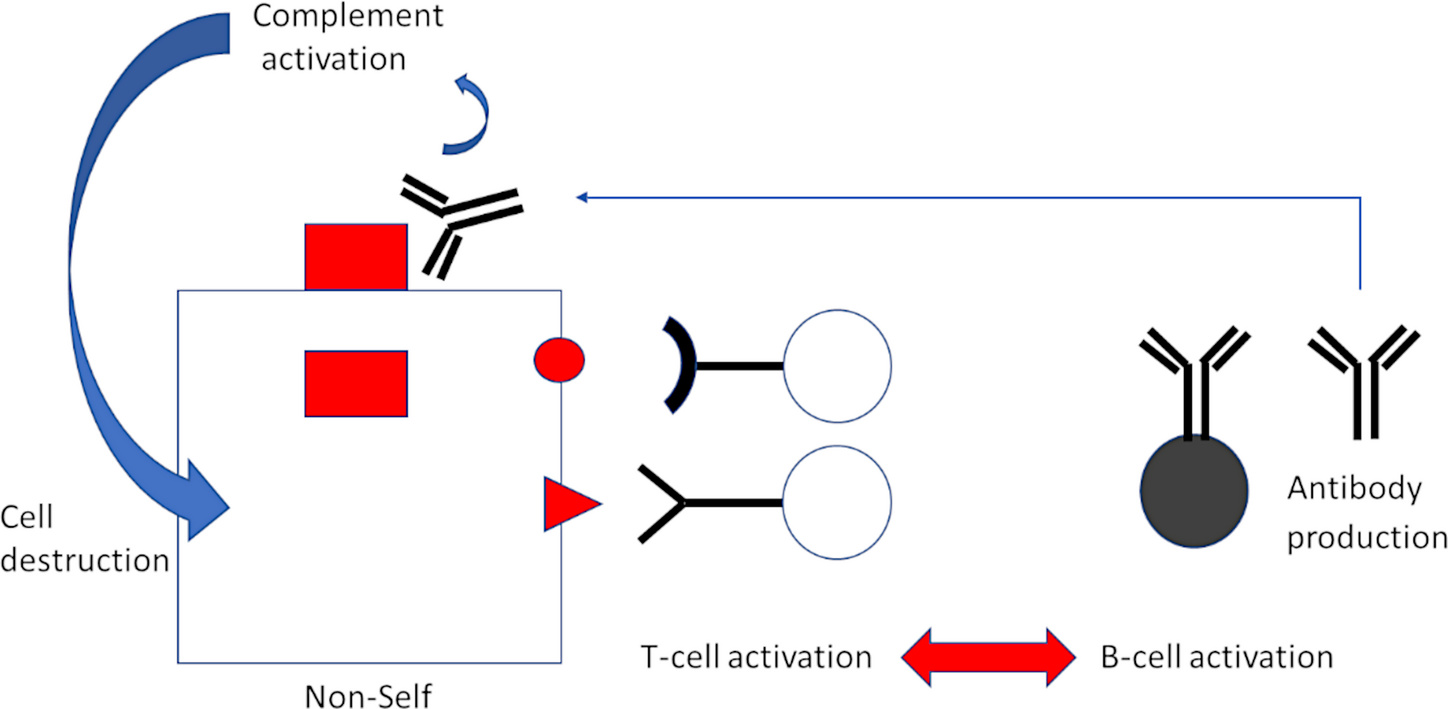
Всякий раз, когда клетка вырабатывает определенный белок, она генерирует несколько его копий. Несколько из этих копий будут специально разбиты на мелкие фрагменты; затем они транспортируются на поверхность клетки вместе со специфической молекулой-носителем, называемой MHC 1.
Там фрагменты становятся доступными для взаимодействия и распознавания с помощью CTL. Лимфоциты, принадлежащие к разным “клонам”, будут распознавать разные фрагменты; все клетки данного клона Т-клеток будут нести одни и те же рецепторы Т-клеток и распознавать одни и те же фрагменты белка, но клетки, принадлежащие к разным клонам, будут отличаться по своей антигенной специфичности (рисунок 1).
Таким образом, Т–клетка, которой удается найти и связать свой родственный фрагмент белка, будет активирована для выброса смертельных токсичных веществ в клетки-мишени и в них.
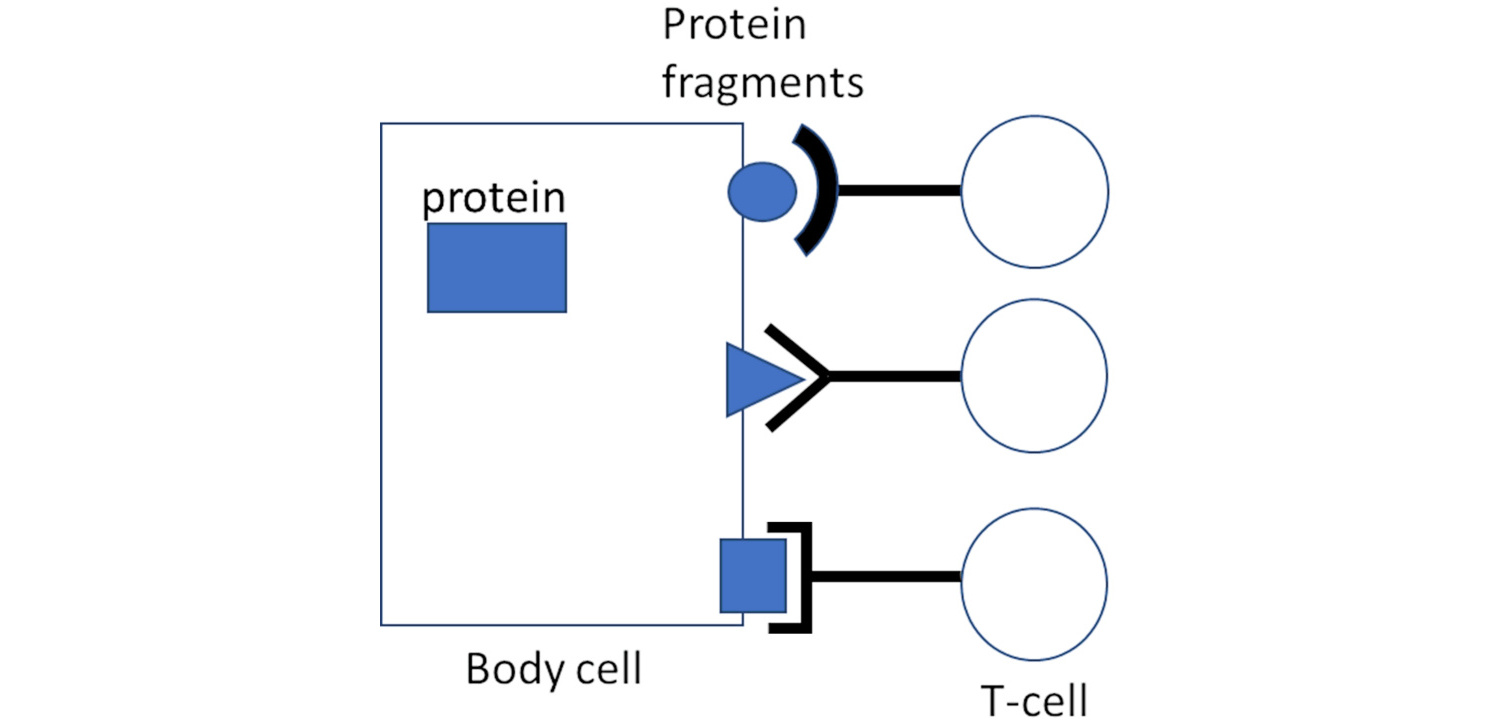
Если белок, фрагменты которого привлекли и активировали эти CTL, был закодирован вирусом, то результатом будет разрушение инфицированной вирусом клетки, что полезно и необходимо для искоренения вирусной инфекции.
Однако обратите внимание, что процесс фрагментации и презентации белка является совершенно общим — он не ограничивается вирусными или другими “чужими” белками, а скорее относится и к собственным “чужим” белкам организма.
Поэтому жизненно важно предотвратить активацию CTL, которые распознают фрагменты этих “собственных” фрагментов, полученных из белка. Как это достигается?
Представьте себе взаимодействие между представленным фрагментом белка и его “рецептором” на Т-клетке как между замком и ключом.
Существует множество различных ключей (фрагментов), входящих в множество различных замков (Т-клеточных рецепторов). Известно, что поистине невероятное разнообразие замков возникает уже во время внутриутробного развития плода.
Как это происходит? Формируются ли замки в ответ на фрагменты (ключи), появляющиеся в процессе разработки? Тогда, поскольку плод обычно не подвергается воздействию каких-либо вирусных инфекций, CTL будет снабжен рецепторами, распознающими исключительно “собственные” фрагменты белка; но эти самореактивные клоны CTL вряд ли могут служить полезной цели.
Если, с другой стороны, разнообразие блокировок должно возникать случайно и случайно, без необходимости в каком-либо инструктивном шаблоне (ключе), тогда миллиарды лимфоцитов, которые распознают “не—я” — посторонние агенты, включая вирусные белки, — должны генерироваться наряду с теми, которые распознают “я”.
Интересно, что сегодня известно, что последнее имеет место [8]. Удивительно, что лимфоциты, распознающие “себя”, заставляют замолчать или сдерживаются на протяжении всей жизни, не позволяя им бессмысленно атаковать здоровые клетки организма.
Иногда происходят несчастные случаи, которые могут привести к аутоиммунным заболеваниям. Появляются Т-клетки, которые реагируют против белков печени, возникает аутоиммунный гепатит. Появляются Т-клетки из укрытия, которые реагируют против островков поджелудочной железы, возникает аутоиммунный диабет.
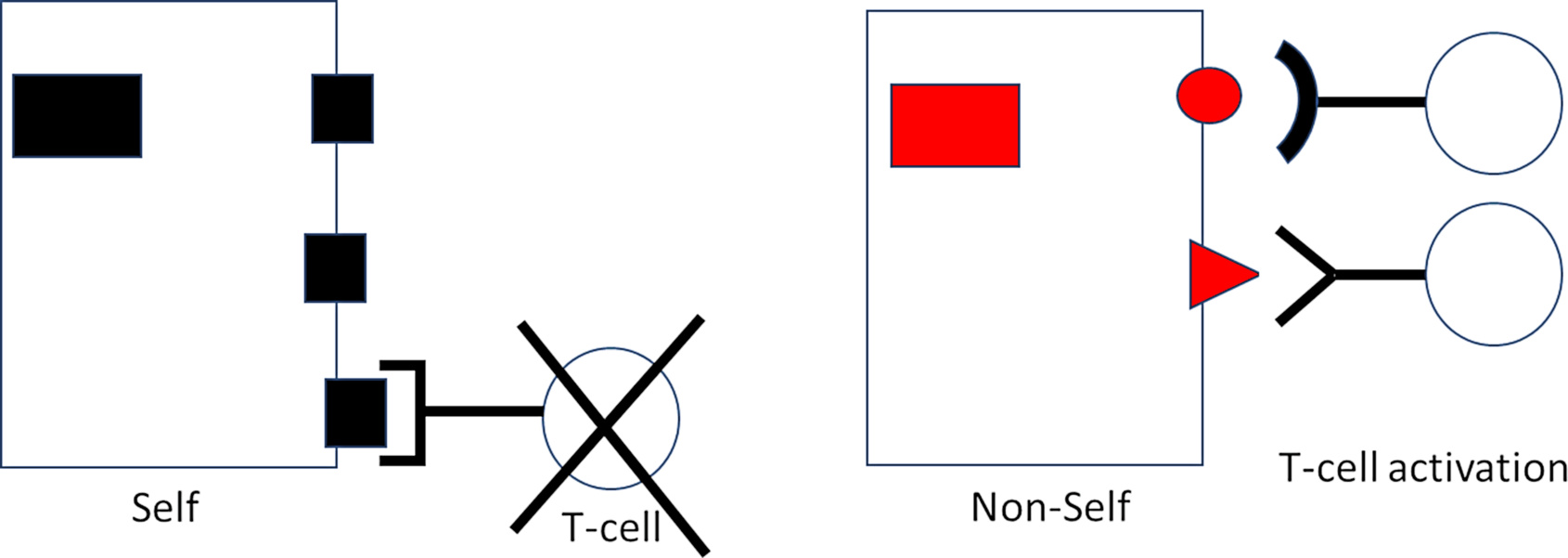
Но, с другой стороны, иммунные клетки, реагирующие практически на все несамостоятельные белки и присутствующие при рождении, готовы вступить в действие при каждом вызове.
Именно по этой причине обычные прививки можно успешно проводить уже в раннем младенчестве. И когда появляется коронавирус, поднимается команда по борьбе с коронавирусом CTL. Когда появляется грипп, поднимается команда по борьбе с гриппом и т. Д. Каждая тренировка укрепляет команду, позволяя быстрее сдерживать противника и эффективнее прекращать заражение.
Но разве такой приобретенный иммунитет не аннулируется и не обходится все новыми вирусными “вариантами беспокойства”? Это не так. Здесь следует отметить, что белок будет генерировать множество фрагментов, которые распознаются многими различными клонами CTL.
Белки, кодируемые мутантом вируса, могут генерировать один или несколько отличающихся фрагментов, но большинство других фрагментов останутся прежними. По этой причине перекрестная реактивность и перекрестная защита на основе CTL существуют между всеми членами данного семейства вирусов.
В частности, в связи с COVID-19 было отмечено, что ранее инфицированные люди действительно иногда могут заразиться другой инфекцией с новым вариантом, но такие повторные заражения почти никогда не носят серьезного характера [9,10].
Это именно то, чего нам следовало ожидать; таким образом, утверждение о том, что появлению вирусных мутаций должна противостоять разработка индивидуальных вакцин, было в корне неверным с самого начала.
Активация Т–лимфоцитов — но в данном случае Т—хелперных клеток, а не CTL — также связана с активацией В—лимфоцитов, и это приводит к выработке антител (рисунок 3).
В то время как CTL распознают фрагменты белков, представленных на поверхности клетки, антитела связываются с самими интактными белками. Затем связанные антитела вызывают активацию другого важного звена иммунной защиты — системы комплемента, что приводит к далеко идущим последствиям.
Активация комплемента вызывает множество воспалительных явлений. Кроме того, сама система комплемента будет атаковать и уничтожать клетку, на поверхности которой происходит активация.
4. Каждая вакцина на основе генов, кодирующая не-себя, крайне опасна
Из вышесказанного следует, что выработка “чужих” антигенов клетками нашего собственного организма неизменно будет провоцировать воспалительные и клеточно-деструктивные процессы.
При вирусных инфекциях это соответствует цели, поскольку приводит к уничтожению пораженных клеток. Большинство вирусов поражают ограниченный спектр тканей, и большинство тканей способны к регенерации, поэтому раны впоследствии могут заживать.
Сторонники вакцин на основе генов обычно утверждают, что эти агенты всего лишь имитируют то, что происходит при реальных вирусных инфекциях.
Таким образом, утверждается, что экспрессия чужеродного белка недолговечна и ограничивается главным образом местом внутримышечной инъекции. Любое повреждение клеток также должно быть ограничено, и поэтому серьезных побочных реакций ожидать не следует.
Ничто не может быть более вводящим в заблуждение и более далеким от истины.
К настоящему времени широко известно, что утверждение о том, что мРНК, упакованная в LNP, остается в месте инъекции, является вопиющей неправдой.
Могут ли липидные наночастицы изменять основные человеческие качества вакцинированных?
Эти “вакцины” быстро распространяются от места инъекции к лимфатическим узлам и кровообращению [11]; и длительная экспрессия в органах и тканях на расстоянии от места инъекции неоднократно документировалась и с помощью ряда аналитических методов [12-15].
А поскольку частицы вакцины могут проникать во все клетки с ядрами, их поглощение неизбежно быстро произойдет в клетках лимфатических узлов, в эндотелиальных клетках, которые выстилают стенки кровеносных сосудов, и в клетках каждой ткани, к которой они попадают.
Этот факт сразу отличает “мРНК-вакцинацию” от естественных инфекций. Очень немногие инфекционные агенты системно нацелены на лимфоциты или эндотелиальные клетки.
Среди последних – опасные вирусы, вызывающие геморрагические лихорадки, и бактерии, которые также вызывают опасные для жизни инфекции, например тиф и пятнистую лихорадку Скалистых гор.
В отличие от этого, каждая мРНК-“вакцина” вызывает саморазрушительные процессы в лимфатических узлах и кровеносных сосудах по всему телу.
Были описаны огромные опасности самоатак, происходящих в сети иммунологического контроля [16]. Они включают реактивацию дремлющих инфекций (например, простого герпеса, опоясывающего лишая, ВЭБ, ЦМВ, туберкулеза, паразитов), снижение способности контролировать новые инфекции и активацию или реактивацию новообразований [17].
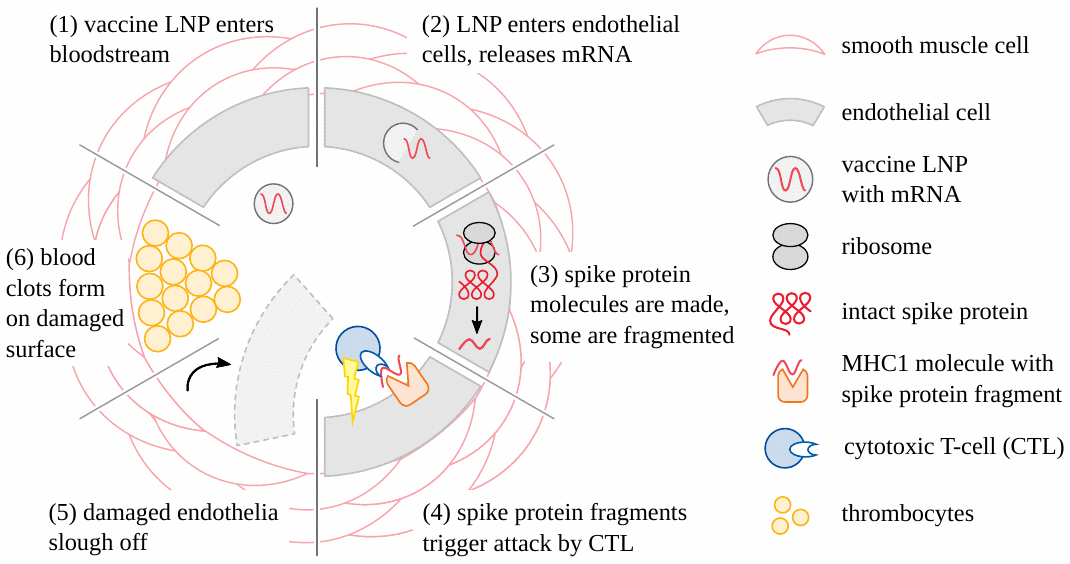
Одновременно, согласованная иммунная атака будет направлена против стенок сосудов, когда и где эндотелиальные клетки будут трансфицированы (рис. 4).
В случае SARS-CoV-2 известно, что специфичные к спайк-белку цитотоксические Т-клетки широко присутствуют в крови здоровых людей. Это может быть связано с предыдущим заражением этим вирусом, но, в качестве альтернативы, также с иммунологической перекрестной реактивностью с другими, родственными коронавирусами [18,19].
С появлением специфических антител атака на клетки, несущие чужеродные белки, будет многократно умножаться и усиливаться благодаря действию комплемента и фагоцитарных клеток. Образование тромбов в результате повреждения эндотелия приведет к нарушению кровообращения. ,
Ишемическая гибель клеток будет иметь необратимые последствия для центральной нервной системы и сердца. Повреждение стенок сосудов предсказуемо приведет к утечке вакцины и ее поглощению клетками соответствующих органов, закладывая семена для множества аутодеструктивных событий.
Накапливающиеся данные подтверждают эти предчувствия, и новое открытие может оказаться отличительным и диагностическим для патологий, вызванных вакцинами: индуцированная вакциной экспрессия белка spike в эндотелиальных клетках и возникающий в результате васкулит будут идти рука об руку.
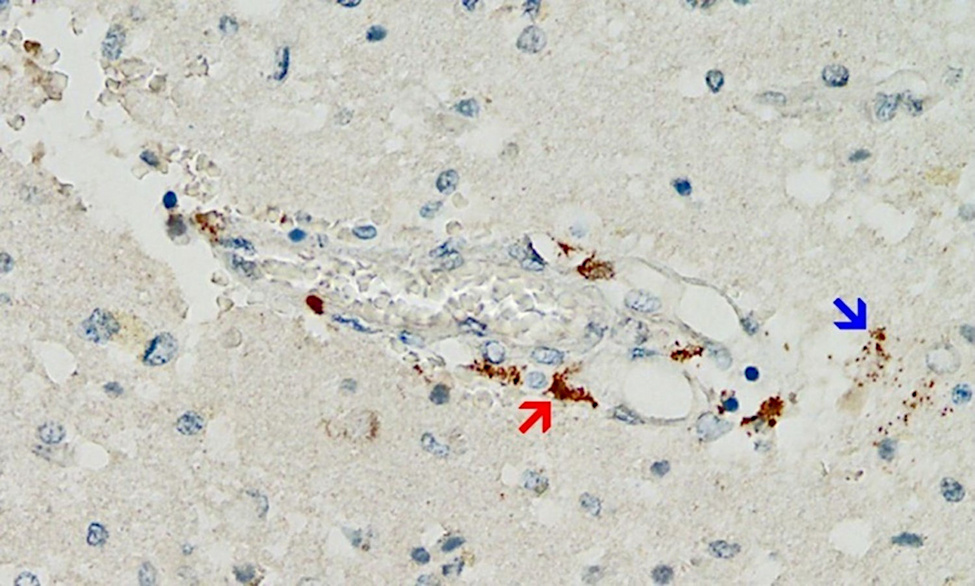
Первая иллюстрация этого принципа была представлена в отчете о случае 76-летнего мужчины, который умер через три недели после получения третьей вакцинации против COVID-19 [20]. Гистопатологические анализы головного мозга привели к выявлению мультифокального васкулита и некротического энцефалита.
В сердце были обнаружены васкулит мелких сосудов и лимфоцитарный миокардит. Спайковый белок был обнаружен в очагах воспаления как в головном мозге, так и в сердце, особенно в эндотелиальных клетках мелких кровеносных сосудов (рис. 5).
Соответствующие контрольные эксперименты подтвердили, что наблюдаемая пиковая экспрессия белка действительно была вызвана инъекциями вакцины, которые получил пациент, а не недиагностированной инфекцией самим вирусом.
Полиорганный васкулит с заметным поражением мелких сосудов в настоящее время становится распространенной причиной нежелательных явлений после вакцинации против COVID-19.
Неоднократно наблюдается поражение капилляров с образованием тромбов в головном мозге и сердце (Мерц [20]; Мерц и Буркхардт, неопубликованные). Такая картина заболевания мелких и мельчайших сосудов является новой и, по мнению авторов, характерна для действия вакцин на основе генов.
Можно ожидать возникновения молниеносных реакций у пациентов, которые были вакцинированы после выздоровления от подлинных инфекций SARS-CoV-2. У таких пациентов будут высокие уровни циркулирующих антител IgG против белка spike [21], и атака комплемента на клетки, трансфицированные вакциной, может быть немедленной и массивной.
Был опубликован отчет о случае внезапной смерти, вызванной миокардитом, после первой вакцинации с прямыми доказательствами активации комплемента в клетках сердечной мышцы [22].
По нашему взвешенному мнению, результат будущих вакцин против мРНК против других патогенов будет во многом таким же, как мы наблюдали с вакцинами против COVID-19.
Это правда, что сам спайковый белок может способствовать свертыванию крови и воспалению без какой–либо помощи со стороны иммунной системы [23].
Тем не менее, уже имеющиеся данные указывают на то, что серьезные, широко распространенные и устойчивые повреждения тканей и кровеносных сосудов в основном вызваны иммунной атакой на клетки, продуцирующие спайковый белок.
Эта атака происходит просто потому, что спайковый белок является несамостоятельным антигеном; и поскольку любая другая мРНК-вакцина будет кодировать свой собственный несамостоятельный антиген, полученный от того конкретного микроба, на который она нацелена, мы должны ожидать, что он причинит вред по тому же механизму и в той же степени.
Эти кошмарные сценарии будут только усугубляться с каждой инъекцией бустера. Катастрофические события нельзя будет ни предотвратить, ни подавить в силу самой их природы.
Катастрофа, разворачивающаяся на наших глазах, могла быть и была [24] предсказана на основе первых принципов иммунологии. Способность различать «я» и «не-я» имеет основополагающее значение для жизни.
Она уже присутствует при рождении и заканчивается только со смертью. Этим нельзя манипулировать или контролировать.
Любая попытка сделать это с помощью мРНК или других вакцин на основе генов обречена на провал.
Подтверждение
Авторы благодарят патологоанатомов, проф. Арне Буркхардту, доктору медицинских наук, и доктору медицинских наук Майклу Мерцу за ценную дискуссию и, прежде всего, за их самоотверженную и новаторскую работу с образцами тканей жертв вакцинации.
Первоначально издано на Врачи за этику ковид
Доктор медицинских наук Сучарит Бхакди, доктор философии Карина Рейсс и доктор медицинских наук Майкл Палмер